Странные сгустки
С середины 2021 года во всем мире сообщалось о необычных, длинных тромбах , обнаруженных в сосудах пациентов с COVID-19 и реципиентов .

«Мы, бальзамировщики, наблюдаем странные сгустки после вспышки COVID. Эти сгустки очень эластичны на ощупь и очень длинные, поскольку они выходят из вен, которые мы используем во время процедуры бальзамирования. Они действительно кажутся дождевыми червями. До сих пор я никогда не видел такого в своей карьере», — сказал The Epoch Times Ларри Миллс, лицензированный бальзамировщик и распорядитель похорон в штате Алабама.
Ричард Хиршман, распорядитель похорон в Алабаме и бальзамировщик с 2001 года, был одним из первых, кто обратил внимание на это явление. Он сказал, что до COVID, возможно, от 5 до 10 процентов людей имели эти сгустки. Теперь они есть более чем на половине тел, которые он видит.
Один бальзамировщик, имеющий лицензию с 2001 года, сказал в интервью: «Я могу с уверенностью сказать вам, что сгустки, которые Ричард показал в Интернете, — это явление, свидетелем которого я не был, вероятно, до середины прошлого года. Это почти все, что я могу сказать об этом. Я ничего не знаю о том, что вызывает тромбы, но, похоже, они начали появляться примерно в середине 2021 года».
Откуда берутся эти странные волокнистые сгустки? Как они формируются?
Состояние с более чем 200 симптомами
С первых дней пандемии врачи осознали, что COVID-19 — это не только заболевание легких, но и заболевание эндотелия и сосудов.
Врачи обобщили список необычных клинических наблюдений COVID-19, включая, помимо прочего, пациентов с тяжелой гипоксией (низкий уровень кислорода), несмотря на относительно нормальную податливость легких при обследовании, тромботические осложнения и постоянные результаты вскрытия сгустков крови (тромбы) в микроциркуляторном русле. легкое.
После острой инфекции COVID-19 было зарегистрировано более 200 различных длительных симптомов длительного COVID, которые могут сохраняться в течение примерно 6–24 месяцев .
Это, пожалуй, самое большое количество симптомов, о которых сообщалось при заболевании.
Наиболее частые симптомы включают одышку, утомляемость, туман в голове, когнитивную дисфункцию, мышечные боли (миалгию), проблемы со сном, тревогу или депрессию.
Хронический, рецидивирующий характер затяжного COVID в основном вызван нарушением иммунной регуляции, гипервоспалением, окислительным стрессом и митохондриальной дисфункцией.
Но как это могло быть и почему? Подсказки появились с 2020 года.
Сгустки крови, вызывающие симптомы
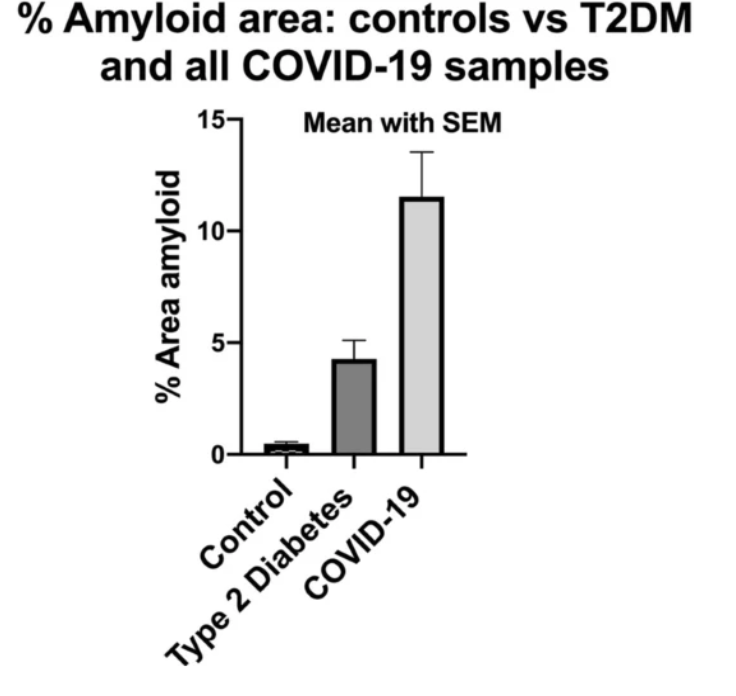
В ноябре 2020 года отчет с обнаружением увеличения количества микротромбов у пациентов с COVID-19 по сравнению со здоровыми пациентами или пациентами с диабетом может разумно объяснить одышку, усталость и постнагрузочный синдром недомогания.
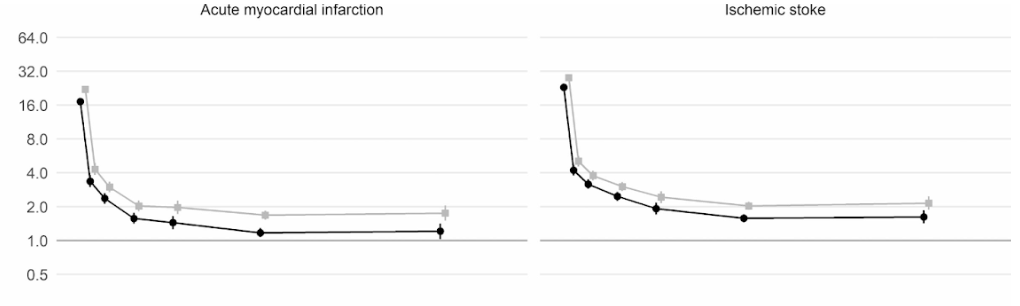
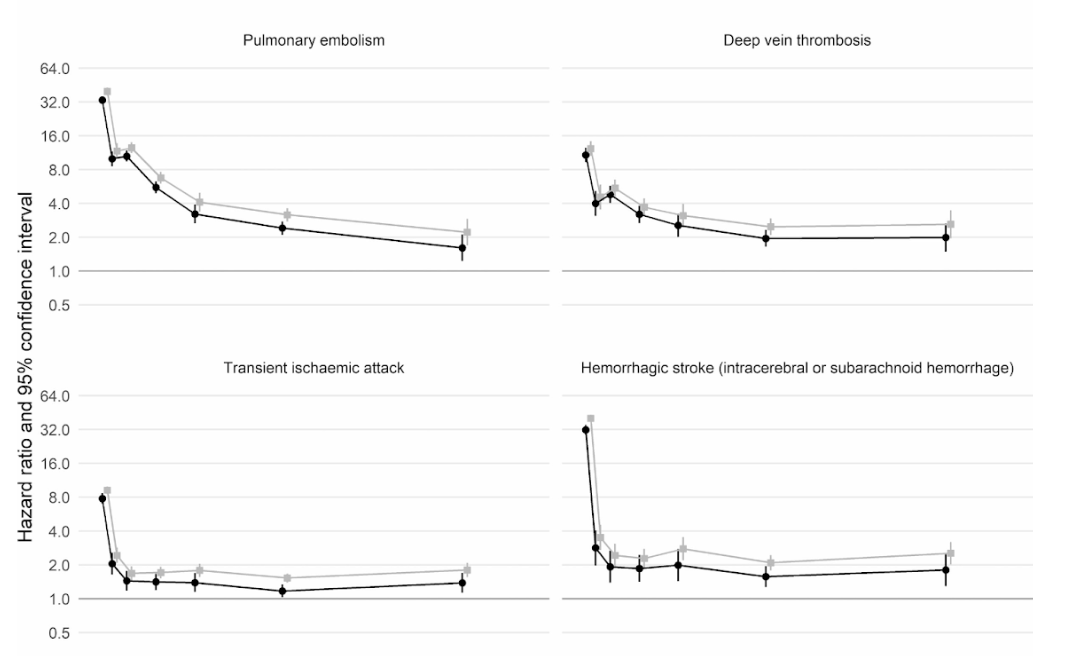
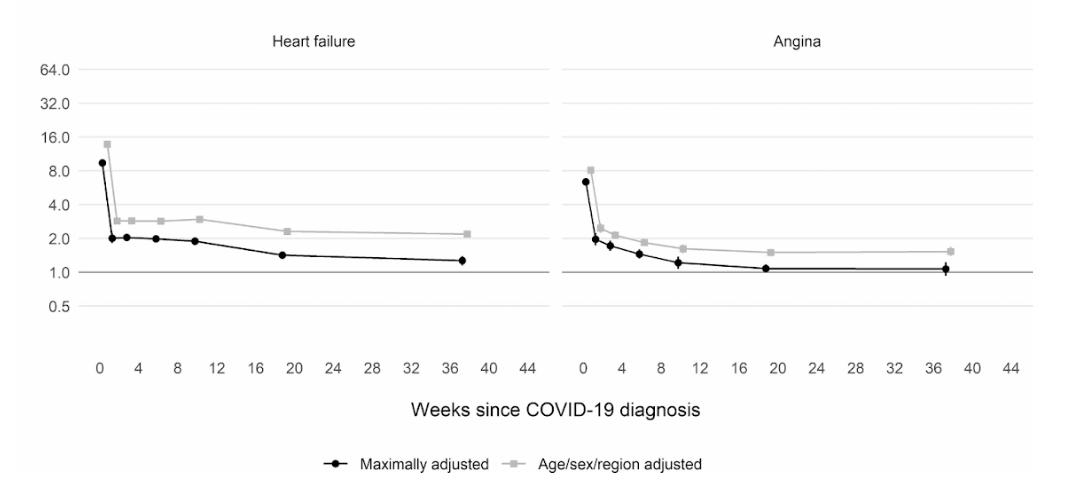
Более того, крупномасштабное когортное исследование в Великобритании, в котором приняли участие 48 миллионов взрослых в Англии и Уэльсе, показало, что в первую неделю после постановки диагноза COVID-19 риск образования тромба в артериальной крови был почти в 22 раза выше, чем у человека без COVID-19. и в 33 раза выше для состояния венозного тромба.
Сгусток артерии может вызвать сердечный приступ или ишемический инсульт, блокируя приток крови к сердцу или мозгу.
Это привело примерно к 10 500 дополнительным случаям проблем, связанных со сгустками крови , т.е. примерно к 7 200 дополнительным сердечным приступам или инсультам и к 3 500 дополнительным случаям легочной эмболии, тромбозу глубоких вен или другим венозным проблемам.
Несмотря на то, что этот риск резко падает и менее чем в четыре раза выше, чем у людей без COVID на второй неделе, он остается высоким (в 2 раза) даже в течение 49 недель после первоначального диагноза. Особенно это касается риска тромбоза глубоких вен. Это тромбы, которые образуются в крупных венах.
 Найт Р., Уокер В., Ип С., Купер Дж. А., Болтон Т., Кин С., Денхолм Р., Акбари А., Аббасизанджани Х., Тораби Ф., Омиги Э., Холлингс С., Норт Т.Л., Томс Р., Цзян Х, Ангелантонио Э.Д., Денаксас С. , Thygesen JH, Tomlinson C, Bray B, Smith CJ, Barber M, Khunti K, Davey Smith G, Chaturvedi N, Sudlow C, Whiteley WN, Wood AM, Sterne JAC; Консорциум CVD-COVID-UK/COVID-IMPACT и Национальное основное исследование здоровья и благополучия COVID-19. Ассоциация COVID-19 с серьезными артериальными и венозными тромботическими заболеваниями: общепопуляционное когортное исследование 48 миллионов взрослых в Англии и Уэльсе. Тираж. 2022, 20 сентября; 146(12):892-906. doi: 10.1161/РАСПИСАНИЕAHA.122.060785. Epub 2022, 19 сентября. PMID: 36121907; PMCID: PMC9484653.
Найт Р., Уокер В., Ип С., Купер Дж. А., Болтон Т., Кин С., Денхолм Р., Акбари А., Аббасизанджани Х., Тораби Ф., Омиги Э., Холлингс С., Норт Т.Л., Томс Р., Цзян Х, Ангелантонио Э.Д., Денаксас С. , Thygesen JH, Tomlinson C, Bray B, Smith CJ, Barber M, Khunti K, Davey Smith G, Chaturvedi N, Sudlow C, Whiteley WN, Wood AM, Sterne JAC; Консорциум CVD-COVID-UK/COVID-IMPACT и Национальное основное исследование здоровья и благополучия COVID-19. Ассоциация COVID-19 с серьезными артериальными и венозными тромботическими заболеваниями: общепопуляционное когортное исследование 48 миллионов взрослых в Англии и Уэльсе. Тираж. 2022, 20 сентября; 146(12):892-906. doi: 10.1161/РАСПИСАНИЕAHA.122.060785. Epub 2022, 19 сентября. PMID: 36121907; PMCID: PMC9484653.
Spike Protein: первое опрокинутое домино
Кровь — это жидкость, которая циркулирует под давлением через кровеносные сосуды во всем нашем теле, подобно воде, текущей по дому, которую вы затем используете, чтобы принять душ, помыть посуду и так далее.
После повреждения сосуда любая «вытекшая» кровь должна быстро превратиться в гель («сгусток»), чтобы заполнить отверстие и свести к минимуму дальнейшую кровопотерю.
В норме плазменная часть крови содержит набор растворимых белков , которые совместно действуют в серии событий активации ферментов , приводящих к образованию фибринового сгустка. Этот процесс является защитным, так как предотвращает чрезмерную кровопотерю после травмы.
К сожалению, механизм свертывания крови может также приводить к образованию нежелательных тромбов внутри кровеносных сосудов (патологический тромбоз), например, к сердечному приступу или инсульту, которые являются основной причиной инвалидности и смерти в мире.
Способ, которым COVID-19 вызывает аномальные тромбы, вызвал множество дискуссий с начала 2020 года.
Похоже, что уникальный спайковый белок вируса запускает каскад многими «нетрадиционными» путями.
Непосредственное вторжение шиповидного белка в клетки эпителия — это первая опрокинутая домино.
Последующие каскадные эффекты в конечном итоге вызывают свертывание крови.
Спайковый белок повреждает клетки эпителия
SARS-CoV-2 проникает в наши клетки через белковый рецептор, называемый ангиотензинпревращающим ферментом 2 (ACE2).
Эндотелиальные клетки (ЭК) экспрессируют большое количество ACE2. ЭК находятся на внутренней поверхности каждого кровеносного сосуда во всем нашем теле, что делает их непосредственной мишенью вирусной инфекции.
Исследования показали, что шиповидный белок сам по себе может повреждать структуру и функцию ЭК, включая повреждение митохондрий и подавление защитной молекулы ACE2 на ЭК.
Исследователи заметили, что как части S1, так и S2 шиповидного белка могут индуцировать ЭК человека для экспрессии пика провоспалительных цитокинов (IL6, IL1B, TNF-альфа и хемокинов CXCL1 и CXCL2).
Впоследствии высвобождение цитокинов инициирует переключающую молекулу (Е-селектин) на мембране эндотелиальных клеток, позволяя им прикрепляться к иммунным клеткам, тем самым инициируя последующие патологические процессы.
Дополнительные исследования шиповидного белка показали, что он активирует воспаление ЭК в зависимости от сигнальных путей интегрина ⍺5β1 и NF-κB и последующей экспрессии молекул адгезии лейкоцитов.
Цитокины представляют собой небольшие белки, секретируемые клетками (в основном Т-клетками и макрофагами). Они имеют много конкретных названий и служат коммуникатором между клетками (клеточная сигнализация) для дальнейших действий. Цитокины — это «почтальоны» организма, которые соединяют и общаются между клетками.
Спайковый белок может вызывать распад соединительных белков между эндотелиальными клетками кровеносных сосудов , что нарушает целостность и функцию наших кровеносных сосудов.
ЭК головного мозга также сильно экспрессируют ACE2. Спайковый белок оказывает аналогичное токсическое воздействие на ЭК головного мозга , вызывая неврологические симптомы (туман в голове, снижение когнитивных функций).
Шипообразные белки запускают каскад свертывания крови
Многие другие клетки, включая эпителиальные клетки легких, энтероциты, выстилающие тонкий кишечник, и перициты сердца, все экспрессируют ACE2.
Спайковые белки не только активируют эпителиальные клетки (ЭК) и способствуют локализованному воспалению. Они также способствуют системному воспалению, поскольку ACE2 находится почти везде в наших основных органах и тканях.
Следовательно, экспрессируется больше провоспалительных генов. Все больше и больше иммунных клеток притягивается и направляется к поврежденным или инфицированным тканям (сосудам в легких, сердце, кишечнике и т. д.).
Ряд последующих событий в совокупности способствуют каскаду свертывания крови:
- Воспаление эпителия, опосредованное комплементом ( эндотелиит ): связывание спайковых белков с ЭК ACE2 активирует путь комплемента и каскад свертывания крови, что приводит к системному эндотелииту (повреждение легких) и прокоагулянтному состоянию (тенденция к образованию тромбов).
- Когда комплемент разрушает эндотелий, высвобождаются прокоагулянтный фактор фон Виллебранда (vWF) и FVIII. Значительное увеличение vWF может привести к образованию мультимеров, которые способствуют росту тромба . vWF секретируется в основном из эндотелиальных клеток и из а-гранул тромбоцитов (производных мегакариоцитов). Это сравнимо с нитью в «бусах и нитке» ожерелья, где бусины представляют собой тромбоциты.
- Тромбоцитарный шторм: Тромбоциты представляют собой небольшой фрагмент мегакариоцитов. Анафилатоксины комплемента C3a и C5a активируют тромбоциты и увеличивают выработку тканевого фактора, дополнительно способствуя состоянию образования сгустков.
Рецепторы ACE2 присутствуют на тромбоцитах, и это может способствовать массивной агрегации тромбоцитов, характерной для тяжелой инфекции COVID-19. - Активация нейтрофилов приводит к образованию нейтрофильных внеклеточных ловушек (NETs), процесс, иногда называемый NETosis, который способствует тромбозу .
- Повреждение ЭК усугубляется активацией толл-подобных рецепторов (TLR) за счет распознавания вирусной РНК, что приводит к увеличению продукции реактивных окислительных частиц (АФК) . Повышение АФК дополнительно повышает экспрессию vWF .
- Шипообразный белок может индуцировать экспрессию и секрецию ряда белков свертывания крови, которые каскадно участвуют в процессе свертывания крови, включая фактор (F)-V, тромбин и фибриноген , способствующие процессу свертывания крови.
Спайковый белок нарушает регуляцию РААС, ухудшая состояние свертывания крови
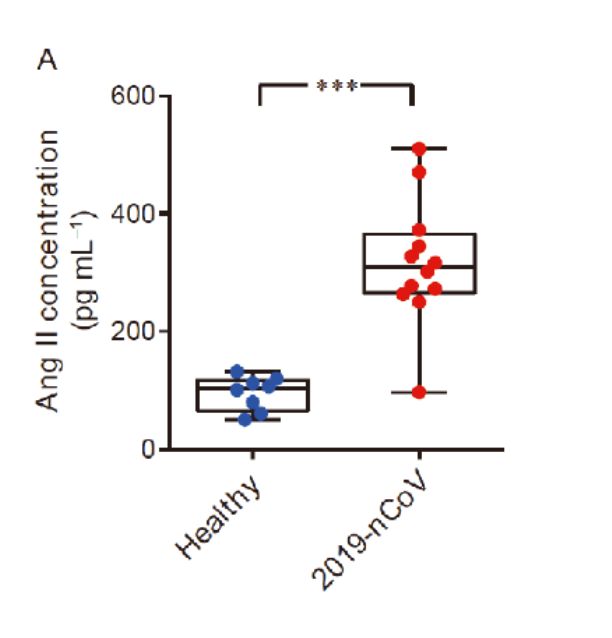
Из-за шиповидного белка, непосредственно взаимодействующего с экспрессией ACE2, у пациентов с COVID-19 наблюдался повышенный уровень ангиотензина II в сыворотке , что указывает на нарушение регуляции системы RAA (ренин-ангиотензин-альдостероновая система, или РААС).
Традиционно считается, что ангиотензин II является нейрогормоном, который стимулирует сокращение гладкомышечных клеток сосудов и отвечает за солевой и водный баланс.
Тем не менее, было проведено множество исследований, подтверждающих идею о том, что ангиотензин II способен инициировать и усиливать воспалительные реакции , ухудшая состояние свертывания крови.
При регулируемом и самоограничивающемся иммунном ответе эти механизмы помогают успокоить локальное повреждение с последующим заживлением и возвращением в состояние покоя ЭК.
Однако для предрасположенных к COVID-19 пациентов или вакцинированных людей факторы, усиливающие образование тромбов, намного тяжелее, чем механизмы заживления, и все они приводят к эскалации тромботического каскада .
Вот краткое изложение первой сцены истории сгустка: разрушение эндотелия, вызванное спайком, высвобождение огромного количества vWF, последующий шторм тромбоцитов, индуцированная гипоксией активация vWF, волокнистая сеть из нейтрофильных внеклеточных ловушек (NETs), а также как повышенный уровень ангиотензина II, все вместе инициируя тромбообразование.
Так возникает механизм свертывания крови. Кроме того, предстоящая вторая сцена играет еще одну ключевую роль во всей истории.
Вакцина против COVID инструктирует клетки производить большое количество шиповидных белков. Нормальные биохимические и физиологические процессы «захватываются», чтобы производить ненормальное количество этих шиповидных белков.
Эти аномальные количества шиповидного белка оказывают более неожиданное прямое воздействие на сгустки.
Шипообразные белки напрямую нарушают механизм растворения тромба
У нормального здорового человека тело при наличии сгустка крови разрушает его в процессе фибринолиза. Это естественный заживляющий и уравновешивающий механизм, предотвращающий обилие тромбов.
Во время этого процесса активатор тканевого плазминогена (ТРА, поступающий из эндотелия) помогает плазминогену превратиться в плазмин, а затем генерировать d-димер (небольшой фрагмент белка, остающийся после растворения тромба).
Было обнаружено, что фибриноген в крови может свертываться в аномальную «амилоидную» форму фибрина, которая (как и другие β-богатые амилоиды и прионы) относительно устойчива к протеолизу (фибринолизу).
Это сильно проявляется в обедненной тромбоцитами плазме (БТП) лиц с длительным течением COVID. Обширные амилоидные микросгустки фибрина могут сохраняться.
В выдающемся исследовании Гроббелара, опубликованном в Bioscience Reports в августе 2021 года, биомаркер S1 (или вторгающаяся часть шиповидного белка) сам по себе может индуцировать устойчивость фибрина к фибринолизу , что приводит к беспрепятственному образованию микросгустков.
Когда шиповидный белок S1 добавляли к здоровому PPP, это приводило к структурным изменениям β- и γ-фибрина (огена), комплемента 3 и протромбина. Эти белки были в значительной степени устойчивы к трипсинизации в присутствии шиповидного белка S1.
Таким образом, результаты показывают, что присутствие шиповидного белка в кровотоке может способствовать статусу гиперсвертывания и может вызвать существенное нарушение процесса растворения сгустка.
Такое литическое нарушение может привести к постоянным большим микросгусткам, о которых сообщали люди и которые были обнаружены в образцах плазмы пациентов с COVID-19.
Эти микросгустки закупоривают капилляры и, таким образом, ограничивают прохождение эритроцитов и, следовательно, кислородный обмен, который фактически может лежать в основе большинства этих симптомов.
Спайковые белки образуют амилоидоподобное вещество
Кроме того, ко всеобщему удивлению, идентифицированы шиповидные белки, представляющие семь амилоидогенных последовательностей и способные образовывать амилоидоподобные вещества .
Другими словами, эти шиповидные белки подобны тем бета-амилоидным, или тау-, или альфа-синуклеиновым веществам, которые могут вызывать потерю нейронов у пациентов с болезнью Альцгеймера или Паркинсона.
Их структура позволяет легко формировать более плотные нитевидные связанные структуры с продольным скручиванием, а также с перекрестным связыванием, образуя волокнистую структуру, видимую под микроскопом.
Исследователи обнаружили, что образцы плазмы от длительных пациентов с COVID по- прежнему содержат большие аномальные (амилоидные) отложения (микросгустки), которые устойчивы к фибринолизу (по сравнению с плазмой контрольной группы и пациентов с диабетом) даже после трипсинизации (диссоциации клеток после ферментативного расщепления белков). .
После второй обработки трипсином стойкие отложения гранул (микросгустки) растворялись. Количество различных воспалительных молекул значительно увеличилось как в супернатанте, так и в солюбилизированных гранулах COVID-19, по сравнению с контрольными образцами.
Особый интерес представляло значительное увеличение α(2)-антиплазмина (α2AP), различных цепей фибриногена, а также сывороточного амилоида A (SAA), которые были захвачены солюбилизированными устойчивыми к фибринолитикам отложениями гранул.
Таким образом, значительное аномальное образование амилоидных микросгустков, устойчивых к фибринолизу, повышенный уровень α2AP и всплеск воспалительных молекул острой фазы могут быть основными факторами как инфекции COVID-19, так и синдрома, связанного с вакциной против COVID.
Spike Protein ингибирует другой механизм, препятствующий образованию тромбов
Спайковый протеин — это всего лишь один сюрприз за другим.
Сообщалось, что шиповидный белок может конкурентно ингибировать связывание антитромбина и кофактора гепарина II с гепарином , вызывая аномальное увеличение тромбиновой (свертывающей) активности.
Шипообразные белки SARS-CoV-2 в той же концентрации (~ 10 мкг / мл), что и вирусная нагрузка у пациентов в критическом состоянии, могут напрямую вызывать свертывание крови и тромбоз в модели рыбок данио.
Подводя итог, можно сказать, что эти неожиданные негативные эффекты шиповидного белка на процесс растворения тромбов, а также его амилоидная природа могут быть ключевыми факторами, способствующими образованию аномальных длинных фиброзных сгустков, наблюдаемых при состояниях, связанных с COVID.
Spike Protein — это дымящийся пистолет
Имеются клинические доказательства того, что спайковый белок SARS-CoV-2 был обнаружен в сгустках крови, взятых у пациентов с COVID-19, перенесших острый ишемический инсульт и инфаркт миокарда.
Недавнее исследование, проведенное кардиологами из Университета Колорадо, проливает свет на решающую роль шиповидного белка в патологии COVID и травм, связанных с вакциной против COVID.
Они проанализировали семь пациентов с COVID-19 и шесть вакцинированных мРНК пациентов с повреждением миокарда и обнаружили почти идентичные изменения в паттернах профиля генов, которые предрасполагают их к состоянию свертывания крови , воспалению и дисфункции миокарда.
Иными словами, вне зависимости от того, был ли миокардит вызван вирусом или вакциной, экспрессия генов, ответственных за протромботическое состояние в ответ на шиповидный белок, воспаление и дисфункцию миокарда, претерпевала сходные изменения.
Основываясь на анализе генов, COVID-19 и поствакцинальное повреждение мРНК имеют общий молекулярный механизм.
Паттерн измененных генов включает пониженную регуляцию ACE2, соотношения ACE2/ACE, AGTR1 и ITGA5 и повышающую регуляцию ACE и F3 (тканевой фактор).
Что еще более тревожно и о чем ранее не сообщалось, так это то, что тромбоз микрососудов был обнаружен у поствакцинированных пациентов, что указывает на то, что белок шипа сам по себе способен вызывать образование тромбов у восприимчивых пациентов.
Верхушка айсберга
Основываясь на причинно-следственной связи между вакцинами ChAdOx1-S (аденовирусная вакцина AstraZeneca против COVID) и тромбозом с синдромом тромбоцитопении, информация о продукте для ChAdOx1-S была обновлена , чтобы включить тромбоз с синдромом тромбоцитопении в качестве очень редкого побочного эффекта.
Это было названо вакциноиндуцированной иммунной тромботической тромбоцитопенией (VITT) в связи с тем, что почти у каждого пациента в этих отчетах в их организме были выявлены высокие уровни антител к тромбоцитарному фактору 4 (PF4) -полианионные комплексы.
Эти необычные тромбы в сочетании с тромбоцитопенией были зарегистрированы преимущественно у женщин в возрасте до 60 лет. Соответственно, несколько европейских стран ограничили использование аденовирусных вакцин в младших возрастных группах.
Этот риск был недавно систематически проанализирован в международном сетевом когортном исследовании из пяти европейских стран и Соединенных Штатов, подтвердив объединенный 30-процентный рост риска тромбоцитопении после введения первой дозы вакцины ChAdOx1-S, а также тенденцию к повышению риска. венозного тромбоза с синдромом тромбоцитопении после Ad26.COV2.S (вакцина Janssen COVID) по сравнению с BNT162b2 (вакцина Pfizer-BioNTech COVID).
Однако это может быть лишь верхушкой айсберга. Есть еще много событий, которые можно отнести к проблемам свертывания, включая внезапную смерть, сердечно-сосудистые события, сердечную смерть, инсульт, инвалидность, тромботические события и т. д.
Кровеносные сосуды есть во всех наших органах. Проблемы с сосудами могут объяснить широкий спектр симптомов от дисфункции до легкого ухудшения работы мозга, сердца, легких и конечностей.
С дополнительным отчетом Энрико Тригозо.
Мнения, выраженные в этой статье, являются мнением автора и не обязательно отражают точку зрения The Epoch Times. Epoch Health приветствует профессиональные обсуждения и дружеские дебаты.
Доктор Юхонг Донг, врач, который также имеет докторскую степень по инфекционным заболеваниям в Китае, является главным научным сотрудником и соучредителем швейцарской биотехнологической компании, а также бывшим старшим медицинским научным экспертом по разработке противовирусных препаратов в Novartis Pharma в Швейцарии.

